不想错过界哥的推送?

2019年国际乳腺癌重量级学术活动的“收官之作”——第42届圣安东尼奥乳腺癌研讨会(SABCS)于12月10日-14日在美国盛大举行。本次会议将会发布哪些乳腺癌领域的重要研究结果,又将对乳腺癌的临床治疗带来怎样的改变?来随我一起先睹为快吧!
HER2靶向治疗
GS1-04.
■APHINITY(BIG4-11)研究:化疗+曲妥珠单抗+帕妥珠单抗vs化疗+曲妥珠单抗的中期总体生存率分析。
APHINITY(BIG4-11)研究是一项随机多中心、双盲、安慰剂对照试验,比较了化疗+曲妥珠单抗+帕妥珠单抗vs化疗+曲妥珠单抗+安慰剂作为可手术治疗的HER2阳性早期乳腺癌患者辅助治疗的疗效差异。
APHINITY研究证实曲妥珠单抗+帕妥珠单抗联合化疗用于辅助阶段可以显著改善HER2阳性早期乳腺癌无浸润性疾病生存(iDFS)率。
此次中期总体生存率分析于2019年12月11日,当地时间上午9:30—9:45在Hall3厅上进行介绍。
P1-18-01.
■不同类型的HER2靶向治疗后达到病理学完全缓解(pCR)的早期HER2阳性乳腺癌患者的复发和死亡风险:一项回顾性探索性分析
背景:在新辅助治疗背景下,抗HER2靶向治疗加化疗后实现pCR的患者的当前标准治疗是在辅助治疗阶段继续进行抗HER2靶向治疗。本项探索性数据分析的目的是报告在罗氏申办的新辅助治疗的研究中获得pCR的HER2阳性早期乳腺癌患者新辅助治疗后的复发和死亡风险。
方法:汇总来自HannaH(NCT00950300)、NeoSphere(NCT00545688)、TRYPHAENA(NCT00976989)、BERENICE(NCT02132949)和KRISTINE(NCT02131064)研究的数据。
分析的新辅助→辅助治疗方案为曲妥珠单抗→曲妥珠单抗(H→H)、帕妥珠单抗加曲妥珠单抗→曲妥珠单抗(PH→H)和帕妥珠单抗加曲妥珠单抗→帕妥珠单抗加曲妥珠单抗(PH→PH)。pCR定义为新辅助全身治疗后切除的乳腺标本和腋窝淋巴结(ypT0/TisypN0)中没有残留浸润癌。无事件生存期(EFS)定义为从随机化开始至疾病复发或进展(局部、区域、远端或对侧)或全因死亡日期之间的时间。采用Kaplan-Meier法估计EFS率。采用Cox回归模型探讨与EFS相关的因素。
结果:1764例患者纳入分析。PH→PH组的中位随访持续时间短于PH→H和H→H组(表1)。总体而言,pCR患者的EFS概率高于残留病变患者(未校正HR=0.33;95%CI:0.25-0.43),这种结果在按激素受体状态和疾病分期分层的患者中保持一致。在实现pCR的患者中,3年EFS率在H→H组中为87%(95%CI:82%–90%),在PH→H组中为92%(95%CI:87%–95%),在PH→PH组中为95%(95%CI:90%–97%)。
表1主要研究结果
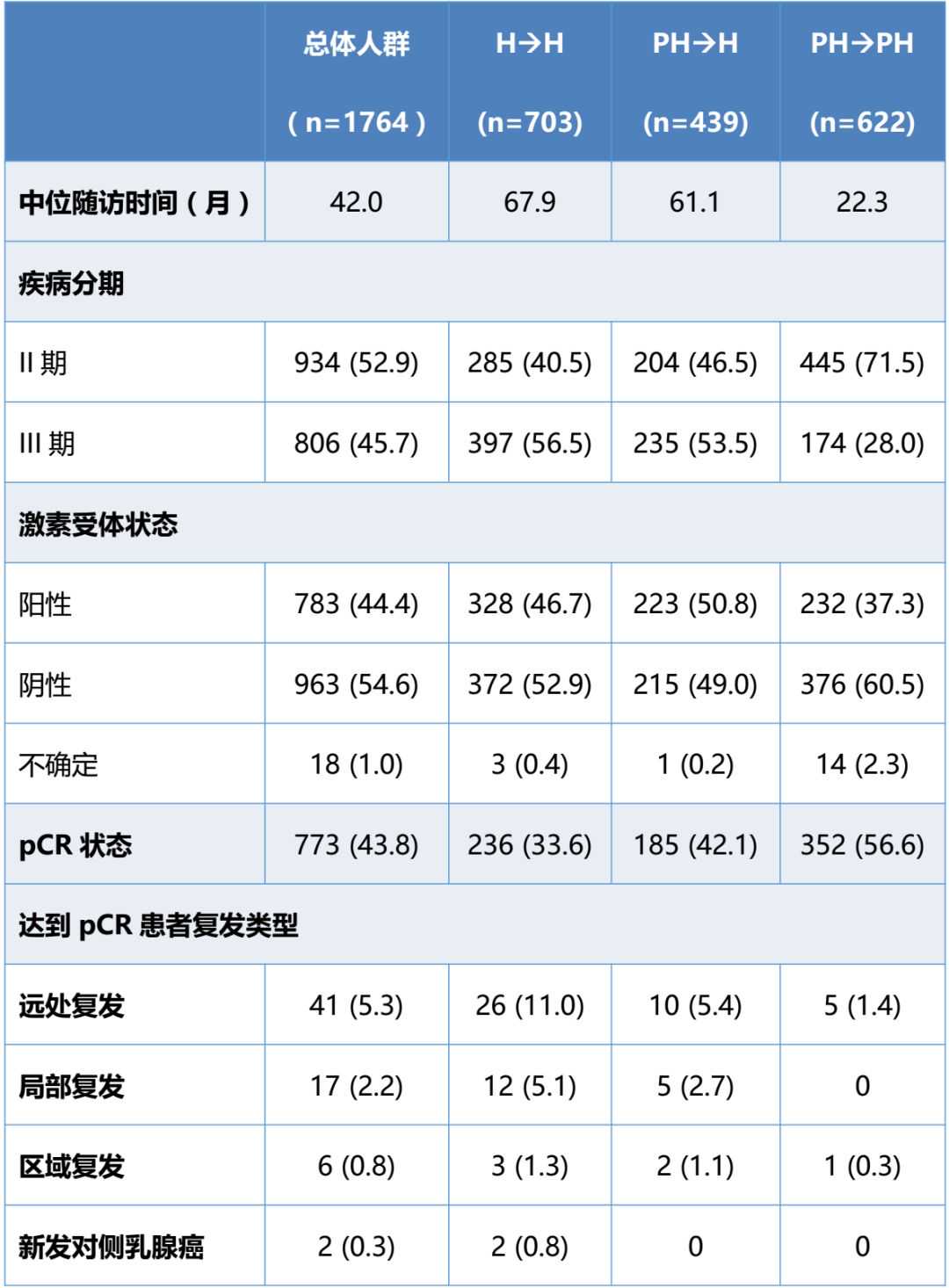
结论:总体而言,与残留病变患者相比,实现pCR的患者具有更好的长期结局,无论雌激素受体(ER)状态或临床分期如何。达到pCR的一些患者仍有复发风险。该探索性数据分析的局限性在于,与其他组相比,PH→PH组基线时III期患者数量较少,随访时间较短。
GS1-05.
■TBCRC033:一项在I期HER2阳性乳腺癌患者中比较Trastuzumabemtansine(T-DM1)与紫杉醇(T)联合曲妥珠单抗(H)辅助治疗的随机II期研究(ATEMPT)
背景:APT试验既往研究证实,辅助TH与乳腺癌HER2阳性小肿瘤患者的有利结局相关。ATEMPT试验旨在确定辅助T-DM1治疗的毒性是否低于TH,以及是否与I期HER2+乳腺癌患者的临床可接受无病生存期(DFS)相关。
方法:ATEMPT是一项研究者发起的随机、多中心、II期辅助治疗研究。经中心确认的I期HER2+乳腺癌患者按3:1的比例随机分配至T-DM1组或TH组,并接受/kgIV每3周一次(w)治疗17个疗程,或接受T80mg/m2IV联合Hqwx12w(4mg/kg负荷→2mg/kg)治疗,之后接受Hx39w(6mg/kgq3w)治疗。主要终点是比较T-DM1治疗患者与TH治疗患者的临床相关毒性(CRT)发生率,并评价T-DM1治疗患者的DFS。
结果:入组了512例HER2+乳腺癌患者,497例接受治疗(383例T-DM1,114例TH)。入组患者中73%为激素受体阳性,11%的肿瘤为T1a;31%为T1b;57%为T1c。25%接受T-DM1治疗的患者和36%接受TH治疗的患者发生CRT;差异具有统计学意义(p=0.03),但相对下降40%(p=0.95)。2%(9/383)接受T-DM1治疗的患者出现g3/4神经毒性,而接受TH治疗的患者为7%(8/114);17%的患者因不良事件提前终止T-DM1治疗。接受T-DM1治疗的患者的3年DFS率为97.5%(95%CI:95.9%-99.3%),TH为93.2%(95%CI:88.1%-98.7%)。
结论:这是首次报告患者接受T-DM1单药作为I期HER2+乳腺癌辅助治疗。在研究的人群中,该方案的复发率极低。T-DM1的CRT显著少于TH,但未达到预先计划的毒性相对降低40%。
PD4-08.
■FDA分析:紫杉醇联合曲妥珠单抗辅助治疗研究(APT)vs.外部临床研究的生存结局
背景:APT研究是一项在淋巴结阴性的HER2阳性早期乳腺癌(EBC)小肿瘤患者中进行紫杉醇联合曲妥珠单抗辅助治疗的单臂研究。尽管APT研究中的治疗方案已被临床采用,但单臂研究毕竟存在局限性,对于这些患者(尤其是T1c或T2期患者)能否从更强的化疗方案中获益,研究者颇感兴趣。
方法:研究者汇总了提交至FDA以支持相关药物获批用于HER2阳性EBC辅助治疗的5项随机研究(BCIRG006、NSABP-B31、HERA、N-9831和APHINITY)的数据(N=19087)。采用倾向性评分,将接受曲妥珠单抗联合蒽环类药物/环磷酰胺/紫杉类(ACTH)(n=932)或紫杉类/卡铂(TCH)(n=434)治疗的患者与APT研究中接受紫杉醇和曲妥珠单抗(TH)治疗的患者(n=406)进行1:1匹配。仅接受蒽环类药物/环磷酰胺/紫杉类(ACT)治疗的患者(n=374)也与APT研究中接受TH治疗的患者进行1:1匹配。
倾向性评分模型包括年龄、肿瘤大小(Tim/T1a、T1b、T1c、T2)、分级和激素受体状态。对接受ACTH或TCH治疗的患者与APT研究中的TH治疗患者以及接受ACT治疗的患者与APT研究中的TH治疗患者的iDFS和总生存期(OS)进行比较。
结果:匹配后,纳入了305例来自APT研究的患者以及305例来自5项注册研究的接受ACTH或TCH治疗的患者。来自APT研究的169例患者也与169例接受ACT治疗的患者匹配成功。采用倾向性评分匹配充分平衡了患者的基线年龄和疾病特征。iDFS和OS结果如下表所示,ACTH或TCH治疗组患者与TH治疗组患者的结果相似。基于肿瘤大小的曲妥珠单抗治疗亚组分析结果也相似。
表2:iDFS和OS
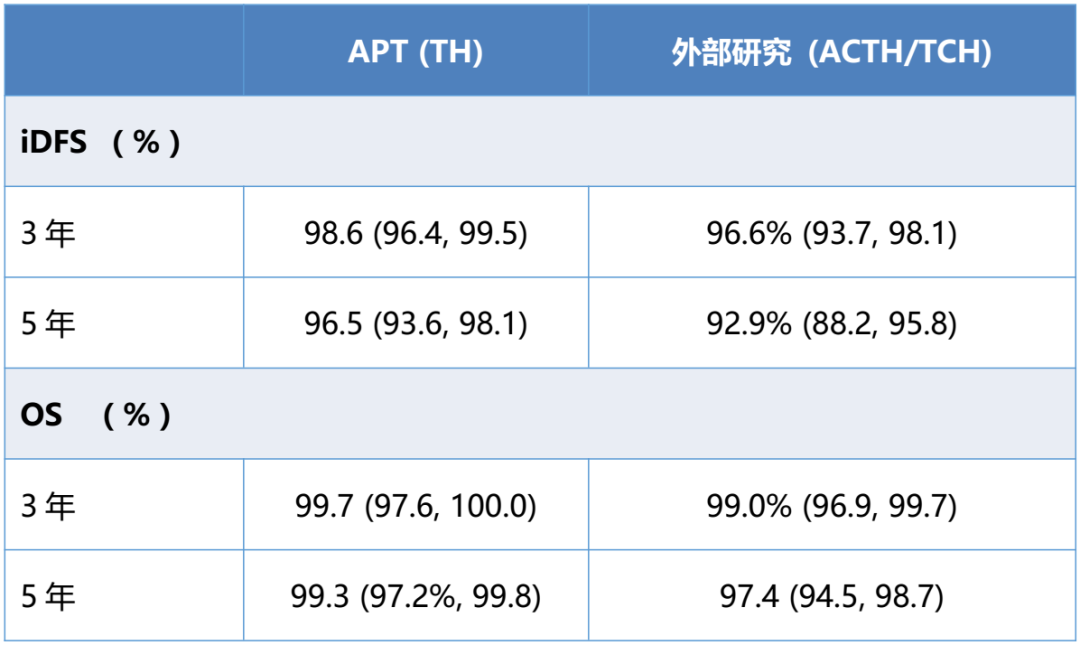
结论:以外部研究作为对照有助于对单臂研究的深入分析。上述探索性研究结果进一步支持了化疗降阶梯治疗在低危HER2阳性EBC患者中的应用。
免疫治疗
PD1-07.
■晚期三阴性乳腺癌(TNBC)中PD-L1免疫组化检测方法协调性的探索性分析:一项IMpassion130的回顾性子研究
IMpassion130研究证实,在意向治疗(ITT)和PD-L1+转移性TNBC人群中,一线Atezolizumab联合白蛋白紫杉醇(A+nP)较安慰剂联合白蛋白紫杉醇显著改善了无进展生存期(PFS)。SP142是目前唯一可用于选择从A+nP治疗中获益患者的经过验证的检测方法。
此次探索性分析的目的是尝试调整SP263,22C3检测界值去识别与SP142IC≥1%最匹配的人群,来协调不同检测之间的一致性。分析结果将于当地时间2019年12月11日上午7:00—9:00在大会上进行介绍。
PD1-05.
■Atezolizumab(Atezo)联合Trastuzumabemtansine或联合曲妥珠单抗和帕妥珠单抗治疗HER2阳性乳腺癌患者,以及Atezo联合多柔比星和环磷酰胺治疗HER2阴性乳腺癌患者:一项多队列Ib期研究的安全性和生物标志物结果
背景:化疗和HER2靶向抗体是多种背景下HER2+乳腺癌的标准治疗。Atezo+化疗改善了PD-L1+晚期TNBC患者的PFS和OS。本研究评价了以Atezo为基础的新型联合治疗在HER2+和HER2-乳腺癌中的安全性,临床活性及肿瘤微环境的变化。
方法:GO29831(nct0265915)是一项多队列Ib期研究,在乳腺癌患者中评价了含Atezo的联合治疗的安全性,探索性评价了临床活性和生物标志物。通过VENTANASP142IHC分析、CD8IHC和基于RNA的基因表达特征评估治疗前和治疗中活检的PD-L1状态。患者人群和干预措施见表3。
表3患者人群及干预措施
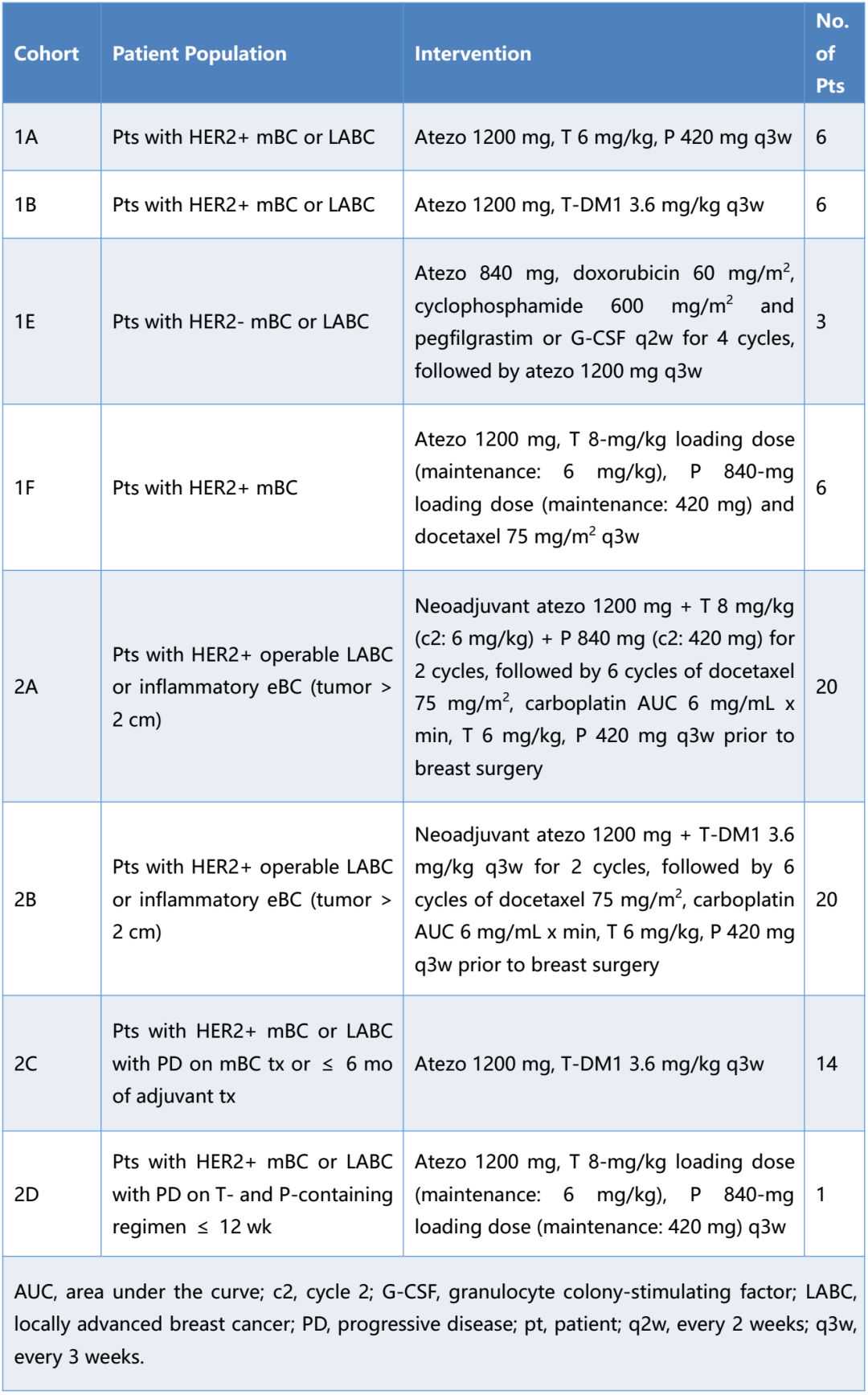
结果:8个治疗队列中有76例患者可进行安全性评价。除已确立的每种药物的安全性特征外,未观察到新的安全性信号。两个既往周期的Atezo联合抗HER2治疗对SOC方案预期的pCR率无不良影响。联合使用Atezo+T-DM1或Atezo+T+P时,在HER2+早期乳腺癌和转移性乳腺癌(mBC)中均观察到PD-L1表达肿瘤浸润免疫细胞增加。
结论:这些联合治疗方案毒性可耐受,安全性信号与个体药物的已知安全性特征一致。生物标志物分析表明,将Atezo与ADCC或ADC药物联合使用可促进肿瘤微环境中适应性免疫系统的激活。
化疗
GS1-08.
■卡培他滨联合多西他赛和环磷酰胺加表柔比星辅助治疗三阴性乳腺癌(cbcsg010):一项开放性、随机、多中心、III期试验
研究背景:TNBC的标准辅助化疗包括紫杉类和蒽环类药物。卡培他滨联合治疗可能会增加疗效获益,但缺乏可靠的数据。该研究评价了卡培他滨联合TNBC辅助治疗方案的疗效和安全性。
研究方法:这是一项在中国开展的随机、开放性、III期试验(NCT01642771)。术后符合入组要求的早期TNBC女性患者被随机分配(1:1)接受卡培他滨治疗[3个周期的卡培他滨和多西他赛治疗,然后3个周期的环磷酰胺、表柔比星和卡培他滨(TX-XEC)]或对照治疗[3个周期的多西他赛治疗,然后3个周期的环磷酰胺、表柔比星和氟尿嘧啶(T-FEC)]。主要终点为5年DFS。
研究结果:入组了585例患者,其中561例患者按照方案接受治疗[分别为卡培他滨组(n=288)和对照组(n=273)]。中位随访时间为67个月。卡培他滨治疗组的5年DFS率长于对照治疗组(86.26%%,HR=0.66,95%;p=0.038)。5年总生存率相似(分别为93.27%和90.55%)。安全性数据与已知的卡培他滨安全性特征一致,且两组间基本相似。
表4事件数目(PPS人群,n=561)
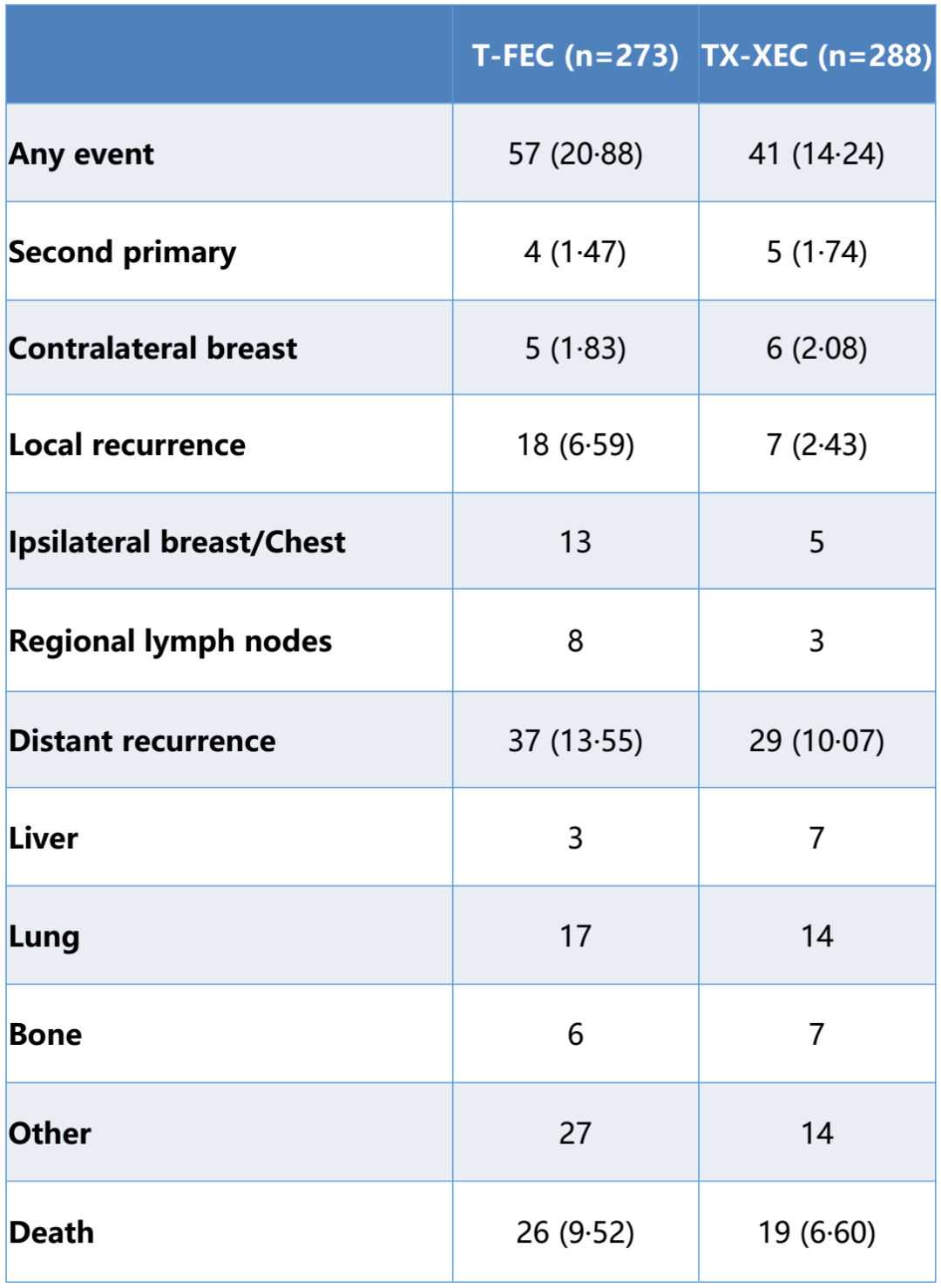
解读:卡培他滨与标准紫杉类或蒽环类药物辅助化疗联合给药时,显著改善了TNBC患者的DFS率,未出现新的安全性问题。
参考文献
[1]!/7946/presentation/2040
[2]!/7946/presentation/519
[3]!/7946/presentation/2041
[4]!/7946/presentation/1978
[5]!/7946/presentation/1939
[6]!/7946/presentation/1937
[7]!/7946/presentation/2043